Síntesis de Fármacos y Compuestos Bioactivos
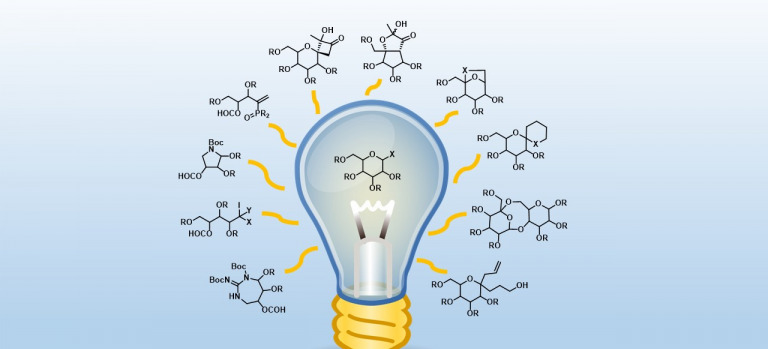
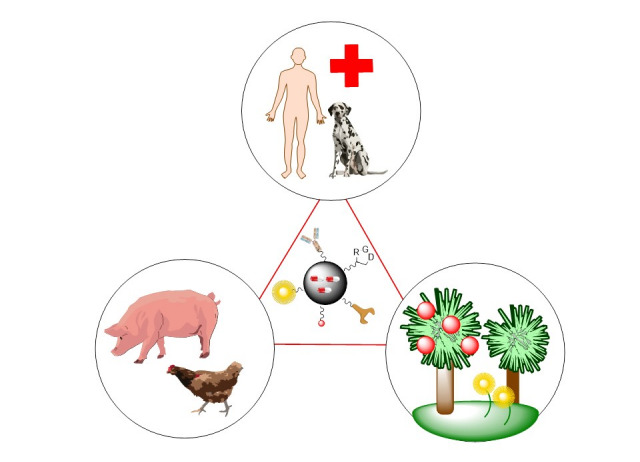
El grupo de Síntesis de Fármacos y Compuestos Bioactivos, creado en el año 2004, está dedicado al desarrollo de nuevas metodologías sintéticas y su aplicación a la obtención de compuestos de interés farmacológico y agrícola (Una Sola Salud).
Estos compuestos incluyen análogos de nucleósidos, péptidos y péptidomiméticos (ej. péptidos antimicrobianos e inhibidores de quórum), derivados fluorescentes de fármacos y sondas médicas, nanofármacos y agentes protectores para cosechas.
Perfil del grupo Síntesis de Fármacos y Compuestos Bioactivos en Digital.CSIC.
Presentación
-
Líneas de investigación

Desarrollo de agentes protectores para cosechas
En colaboración con dos líneas de Agrobiotecnología del IPNA, estamos desarrollando compuestos protectores de cosechas contra fitopatógenos y contra estreses abióticos como la sequía y la salinidad.
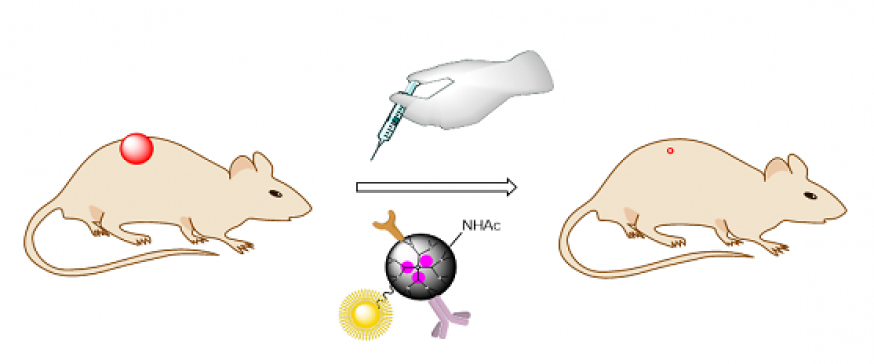
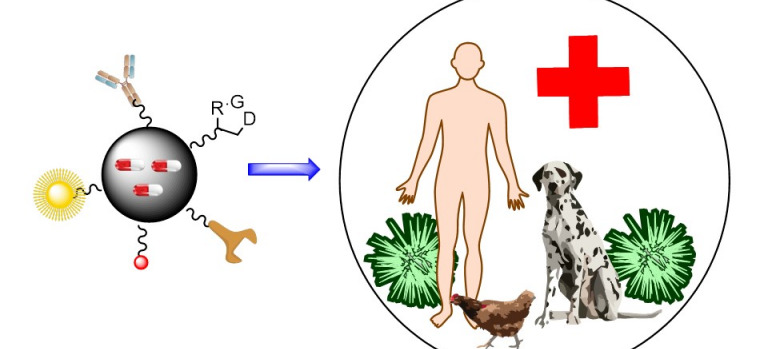
Desarrollo de nanofármacos
En colaboración con varios grupos de Biotecnología y Nanotecnología, estamos preparando nanofármacos para su uso como antimicrobianos y antitumorales, desde fototerapia a nanoparticulas para el transporte selectivo de antitumorales, antimicrobianos o sondas médicas. Las nanopartículas están...
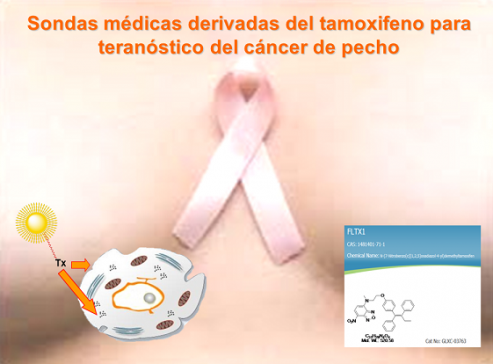
Desarrollo de derivados fluorescentes de fármacos y sondas médicas
En colaboración con la ULL, se han desarrollado análogos fluorescentes del tamoxifeno, antitumoral muy usado para tratar el cáncer de mama, como sondas médicas y nuevos fármacos.
Preparación de péptidos antimicrobianos e inhibidores de quorum sensing
Nuestro grupo está desarrollando péptidos antimicrobianos para biomedicina, ganadería y agricultura, y también compuestos con potencial acción inhibidora del quorum sensing. Varios de los resultados se han patentado y han dado lugar a comunicaciones internacionales.

Modificación selectiva de amino ácidos y péptidos (site-selective peptide modification), para desarrollar fármacos y catalizadores peptídicos
La modificación selectiva de péptidos permite generar fácilmente bibliotecas variadas de péptidos a partir de unos pocos sustratos de partida, y ahorrar tiempo y recursos en el proceso de descubrimiento de fármacos y catalizadores peptídicos. Nuestro grupo ha introducido “unidades modificables”...
Desarrollo de procesos químicos más eficaces y con menor impacto ambiental
Se desarrollan procesos secuenciales que acoplan varias reacciones iónicas y radicalarias. No hace falta aislar los intermedios y se ahorran materiales, energía y tiempo, y se reducen los residuos a tratar. Estos procesos han servido para fabricar gran variedad de compuestos bioactivos, como...
Formación
Nuevos métodos para convertir sustratos de bajo coste en compuestos de alto valor añadido, por su interés químico y farmacéutico
Esta tesis obtuvo la Mención Industrial y ha sido la primera tesis en la ULL del programa de Doctorados Industriales. Calificación: Sobresaliente cum laude.
Directora: Alicia Boto (CSIC)
Codirectores: Dácil Hernández (CSIC) y Gabriel García-Llanos (BIOSIGMA SL)
Carmen Carro Sabina
Procesos secuenciales para la síntesis de aminas quirales a partir de amino ácidos y de péptidos
Procesos secuenciales de escisión radicalaria-oxidación-adición de nucleófilos: aplicación a la modificación selectiva de péptidos y a la síntesis de productos bioactivos
Síntesis estereoselectiva de análogos de alcaloides y de nucleósidos por medio de un proceso secuencial de fragmentación-adición de nucleófilos
Modificación de productos Bioactivos: Aproximación a la Síntesis de análogos simplificados de enzimas
Modificación de productos Bioactivos: Síntesis de derivados de aminoácidos, péptidos y fármacos antitumorales
Procesos Secuenciales estereoselectivos para la síntesis de precursores de productos bioactivos
Síntesis en un paso de beta-amino ácidos a partir de alfa-amino ácidos. Preparación de alfa,beta-péptidos
Reactividad de Radicales Alcoxilo y Carboxilo. Abstracción Intramolecular de Hidrógeno y beta-Fragmentación: Aplicaciones Sintéticas
Estudio del Mecanismo de Fragmentación de Radicales Alcoxilo Anoméricos y Radicales Carboxilo: Intermedios Radicalarios e Iónicos. Aplicaciones a la Síntesis de Carbociclos y Heterociclos Nitrogenados
Financiación

Nuevos agentes para la lucha selectiva contra patógenos: Inhibidores del Quorum Sensing y péptidos antimicrobianos patógenoespecíficos (SELECTFIGHT)
En Ejecución

Preparación de péptidos antimicrobianos de uso en salud humana y agricultura
Finalizado

Preparación de péptidos antimicrobianos de uso en salud humana y agricultura
Finalizado

Preparacion de peptidos antimicrobianos de uso en salud humana y agricultura (SAF2013-48399-R)
Finalizado

Utilización de los desechos del cultivo del plátano de Canarias: Aplicabilidad frente a patologías de la piel
Raquel Marín (Universidad de La Laguna)
Finalizado

Métodos prácticos, de alcance y bajo coste para despertar vocaciones científicas en épocas de crisis (FCT-14-8265)
Finalizado

Drug discovery for the treatment of selected protozoa (Toxoplasma, Neospora and Acanthamoeba)
Hany Elsheikha (Universidad de Nottingham)
Finalizado

Nuevas metodologías para la modificación selectiva de péptidos (bioactivos o catalíticos) y para obtener azanucleotidos (CTQ2009-07109)
Finalizado

Síntesis estereoselectiva de análogos de alcaloides citotóxicos
Finalizado

Síntesis Estereoselectiva de Compuestos Nitrogenados con Posible Actividad Farmacológica: Amino ácidos, Azanucleósidos, Alcaloides y Análogos Sintéticos (CTQ2006-14260)
Finalizado

Síntesis de Alcaloides Bioactivos y Análogos Sintéticos a partir de Amino Ácidos
Finalizado

Síntesis de Alcaloides y Nucleósidos Acíclicos con Potencial Actividad Farmacológica a partir de Amino Ácidos y Carbohidratos
Rosendo Hernández González
Finalizado

Nueva Metodología Sintética para la Obtención de Alcaloides con Actividad Biológica y Análogos Sintéticos a partir de Aminoácidos
Rosendo Hernández González
Finalizado
Personal
Alicia Boto Castro
Dácil Hernández Mesa
Publicaciones
Conversion of "customizable Units" into N-Alkyl Amino Acids and Generation of N-Alkyl Peptides
An efficient conversion of hydroxyproline >customizable> units into new amino acids with a variety of N-alkyl substituents is described. The process is versatile and can afford valuable N-methyl amino acids and N,O-acetals. In addition, it allows the introduction of N-homoallylic substituents and N-chains with terminal ester, ketone, or cyano groups. These chains could be used for peptide extension or conjugation to other molecules (e.g., by olefin metathesis, peptide ligation, etc.). The transformation is carried out in just two (for R = CHOAc) or three steps (scission of the pyrrolidine ring, manipulation of the α-chain, and the N-substituent) under mild, metal-free conditions, affording products with high optical purity.
Saavedra, Carlos J.; Carro, Carmen; Hernández, Dácil; Boto, Alicia
Metal-Free, Site-Selective Peptide Modification by Conversion of “Customizable” Units into β-Substituted Dehydroamino Acids
Our site-selective modification of serine or threonine units in peptides allows the generation of β-substituted dehydroamino acids, which increase peptide resistance to hydrolysis and may improve their biological properties. Both the terminal and internal positions can be modified, and different customizable units can be activated separately. Remarkably, high Z selectivity is achieved, even at internal positions. The conversion involves a one-pot oxidative radical scission/phosphorylation process by using the low-toxicity (diacetoxyiodo)benzene/iodine system as the scission reagent. The resulting α-amino phosphonates undergo a Horner-Wadsworth-Emmons reaction to produce the dehydroamino acid derivatives (in a Z/E ratio of usually >98:2) under mild and metal-free conditions.
Saavedra, Carlos Javier; Hernández, Dácil; Boto, Alicia
Domino Process Achieves Site-Selective Peptide Modification with High Optical Purity. Applications to Chain Diversification and Peptide Ligation
The development of peptide libraries by site-selective modification of a few parent peptides would save valuable time and materials in discovery processes but still is a difficult synthetic challenge. Herein, we introduce natural hydroxyproline as a convertible unit for the production of a variety of optically pure amino acids, including expensive N-alkyl amino acids, homoserine lactones, and Agl lactams, and to achieve the mild, efficient, and site-selective modification of peptides. A domino process is used to cleave the customizable Hyp unit under mild, metal-free conditions. Both terminal and internal positions can be modified, and similar customizable units can be differentiated. The resulting products possess two reactive chains which can be manipulated independently. The versatility and scope of this process is highlighted by its application to the ligation of two peptide chains, and the generation of peptides with several chains and peptides with conformational restrictions.
Romero Estudillo, Iván Omar; Boto, Alicia
Nucleoside analogues: Synthesis and biological properties of azanucleoside derivatives
The azanucleosides are nucleoside analogues where the furanose ring is replaced by a nitrogen‐containing ring or chain. Many azanucleosides are potent antiviral, anticancer and antimicrobial agents, or serve as valuable components of oligonucleotides with improved stability, binding or hybridization properties. Therefore, the development of new analogues is a very active area in medicinal and synthetic chemistry. Their synthesis and their interesting biological properties are discussed in this microreview.
Hernández, Dácil; Boto, Alicia
Unique SERM-like properties of the novel fluorescent tamoxifen derivative FLTX1
Tamoxifen is a selective estrogen receptor modulator extensively used on estrogen receptor-positive breast cancer treatment. However, clinical evidences demonstrate the increased incidence of undesirable side effects during chronic therapies, the most life threatening being uterine cancers. Some of these effects are related to tissue-dependent estrogenic actions of tamoxifen, but the exact mechanisms remain poorly understood. We have designed and synthesized a novel fluorescent tamoxifen derivative, FLTX1, and characterized its biological and pharmacological activities. Using confocal microscopy, we demonstrate that FLTX1 colocalizes with estrogen receptor α (ERα). Competition studies showed that FLTX1 binding was totally displaced by unlabeled tamoxifen and partially by estradiol, indicating the existence of non-ER-related triphenylethylene-binding sites. Ligand binding assays showed that FLTX1 exhibits similar affinity for ER than tamoxifen. FLTX1 exhibited antiestrogenic activity comparable to tamoxifen in MCF7 and T47D cells transfected with 3xERE-luciferase reporter. Interestingly, FLTX1 lacked the strong agonistic effect of tamoxifen on ERα-dependent transcriptional activity. Additionally, in vivo assays in mice revealed that unlike tamoxifen, FLTX1 was devoid of estrogenic uterotrophic effects, lacked of hyperplasic and hypertrophic effects, and failed to alter basal proliferating cell nuclear antigen immunoreactivity. In the rat uterine model of estrogenicity/antiestrogenicity, FLTX1 displayed antagonistic activity comparable to tamoxifen at lower doses, and only estrogenic uterotrophy at the highest dose. We conclude that the fluorescent derivative FLTX1 is not only a suitable probe for studies on the molecular pharmacology of tamoxifen, but also a potential therapeutic substitute to tamoxifen, endowed with potent antiestrogenic properties but devoid of uterine estrogenicity.
Marrero-Alonso, Jorge; Morales, Araceli; García Marrero, B.; Boto, Alicia; Marín, Raquel; Cury, Débora; Gómez, Tomás; Fernández-Pérez, Leandro; Lahoz Zamarro, Fernando; Díaz, Mario
Conformation and Chiral Effects in α,β,α-Tripeptides
Short α,β,α-tripeptides comprising a central chiral trisubstituted β2,2,3*-amino acid residue form unusual γ-turns and δ-turns in CDCl3 and DMSO-d6 solutions but do not form β-turns. Thermal coefficients of backbone amide protons, 2D-NMR spectra, and molecular modeling revealed that these motifs were strongly dependent on the configuration (chiral effect) of the central β-amino acid residue within the triad. Accordingly, SSS tripeptides adopted an intraresidual γ-turn like (C6) arrangement in the central β-amino acid, whereas SRS diastereomers preferred an extended δ-turn (C9) conformation. A different SRS-stabilizing bias was observed in the crystal structures of the same compounds, which shared the extended δ-turn (C9) found in solution, but incorporated an additional extended β-turn (C11) to form an overlapped double turn motif.
Saavedra, Carlos J.; Boto, Alicia; Hernández, Rosendo; Miranda, José Ignacio; Aizpurua, Jesus M.
Colaboraciones
Carlos Javier Saavedra Fernández
Universidad de La Laguna
E-mail: csaavedr [at] ull.edu.es
Fernando Lobo Palacios
Universidad de La Laguna
Alicia Boto Castro
Datos de contacto
Galería de imágenes y vídeos
Noticias/Blog
- 21 Julio 2025
- 02 Abril 2024
- 01 Diciembre 2023
- 18 Abril 2023
- 19 Enero 2021
- 22 Julio 2020
Otros grupos de investigación